在細胞生物學、免疫研究等領域,高質量的肺組織單細胞懸液是后續流式分析、單細胞測序的核心基礎。傳統手動制備方法易因研磨不均、消化失控導致細胞活性低、雜質殘留多,而借助單細胞懸液制備儀的標準化流程,可顯著提升懸液質量與實驗效率。本文將詳細介紹基于單細胞懸液制備儀的小鼠肺組織單細胞懸液制備全流程,為相關實驗提供可復用的操作范式。
實驗材料:健康小鼠一只、解剖工具一套、單細胞懸液制備儀一臺、消化液1瓶、終止液1瓶、1XPBS 1瓶 、70um濾網1個、離心機1臺;流式細胞儀用于活率檢測

單細胞懸液制備儀
實驗目的:通過單細胞懸液制備儀的標準化操作,實現小鼠肺組織的高效解離,獲得無明顯組織碎片、細胞粘連少的單細胞懸液,同時最大限度保留細胞活性(目標活率≥95%),為后續流式細胞分析、單細胞測序、細胞功能檢測等實驗提供合格樣本,解決傳統手動制備方法中 “細胞活率低、純度差、重復性弱” 的痛點。
實驗步驟:
1、選取健康小鼠1只,斷頸處死,打開腹腔,取出肺器官
2、用1XPBS洗滌肺器官
3、選取28.5mg肺組織,用眼科剪剪成糊狀
4、放入加滿消化液的離心管中
5、放入單細胞懸液制備儀的管架上,管架預熱5分鐘
6、選擇模塊4進行實驗,實驗結束后儀器自動停止
7、用70um濾網過濾,加入終止液終止消化(消化液:終止液1:2)
8、放到離心機上重懸
9、重懸后棄掉上清,加入少量PBS打散混勻底部沉淀細胞
10、吸取200ul單細胞懸液,加入PI避光染色10分鐘
11、后續進行流式分析,細胞活率為98.67%
實驗效果:

取材
實驗前

實驗后
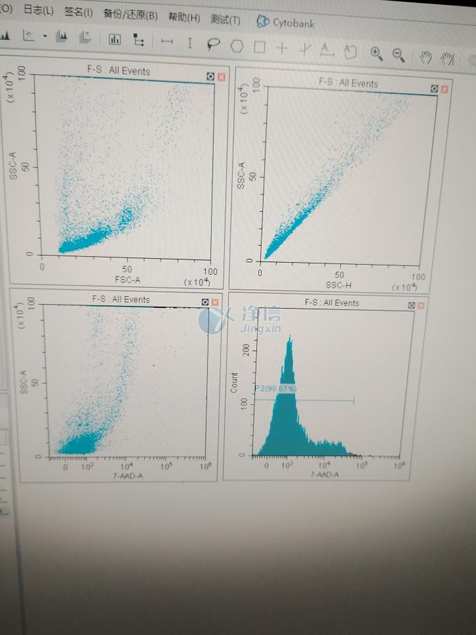
結果分析:活率98.67%
注意事項
1. 機器使用時應保證位置放置平穩
2. 機器適于短時、間歇工作,請勿長時間連續使用,工作時間建議不超過 8 小時。
3. 為保護機器內部的電路和機械,禁止用流水沖洗,而只能用濕布擦拭。
4. 使用過程中如有任何異常,應立即斷電,交由專業人員處理。
5. 機器必須放置在平整的實驗臺上(最好是石質臺面),以防設備工作時振動。
6. 一定要時刻保持警惕狀態,請一切檢查好之后再開啟動!
從實驗結果來看,借助單細胞懸液制備儀的精準控溫與標準化消化模塊,最終獲得的小鼠肺組織單細胞懸液活率高達 98.67%,遠超手動制備(通常活率 80%-90%),且懸液中無明顯組織碎片,完全滿足流式分析對樣本純度與活性的嚴苛要求。這一結果印證了單細胞懸液制備儀在動物組織單細胞處理中的核心價值 —— 它不僅通過管架預熱、專屬模塊設置簡化了操作流程,還避免了人為操作差異導致的實驗誤差,讓肺組織單細胞懸液制備從 “依賴經驗” 轉向 “標準化可控”。
無論是基礎科研中的細胞表型分析,還是臨床前研究中的肺臟疾病機制探索,單細胞懸液制備儀都能為高質量樣本制備提供穩定支持,成為提升實驗效率與數據可靠性的關鍵工具。


















